——培训心得体会展播
9月15、16日有幸参加了公司安排的在中食药组织下培训《如何提高药品生产过程中的关键控制要点及缺陷要点分析》研修班,主讲老师王彦忠老师有着丰富实际生产管理及现场核查经验,所讲课程更贴合于企业实际生产,以及日常生产过程中、上级现场核查高频出现问题及相应解决方案都给出了详尽的讲解,帮助我获得了全新的管理观念和正确、**的现场管理知识技能。
一、生产设备的管理
如何将生产设备的采购和GMP相结合?用户需求标准(URS)对供应商的约束非常的清晰,对关键技术指标、参数、功能都要做详细而明确的描述。设备采购选型应该和生产部结合,不仅要考虑外部大环境、行业内极限水平要求,更要贴合企业内部实际生产需求、当前技术能力及企业的投资成本预算。适合本企业的才是*好的,没有必要是***的。
随着现在设备的自动化、信息化系统的不断进入,我企业设备部分仪表已经不是传统的单一就地显示的仪表了,很多都是通过采集、变送、显示的方式,前端传感器得到的数据*后在各种计算机化系统的软件中显示数据,比如目前的湿热灭菌系统、沸腾干燥机、高效包衣机,回路校准相对于日常离线校准更能达到校准的目的。

二、基于不同注册工艺的批生产过程控制记录设计要点
批记录必须准确、完全、可信地体现产品生产过程的控制要求,首先批记录要和药品注册证、现有批量的工艺验证报告、分析方法验证报告、注册工艺规程、相关质量标准相统一,有统一格式的标准化模板。如果原版空白批记录的修订涉及生产工艺、质量标准、操作流程的实质性变更,不建议做文件变更,应做体系变更。
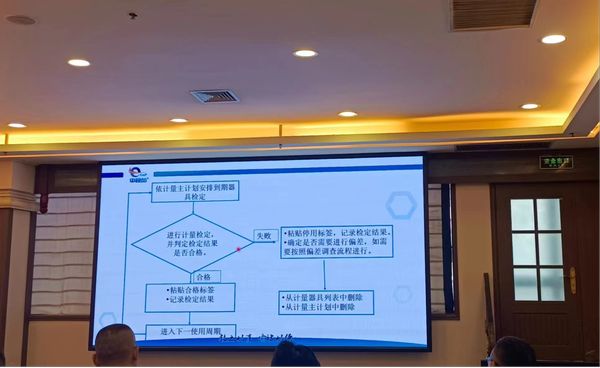
所见即所记,即记录数据或过程是你所观察到的、是可信的,观察的同时在记录上标注填写。结合公司现状,很多细枝末节的问题王老师都有细致的讲解到,建议今后能论证后在批记录中变更。
三、生产现场管理的要点和注意事项
对于生产过程物料及产品管理中:中间产品取样人员有无资质;取样文件项目完整性;取样工具的清洁,有无验证(除非是一次性的);中间产品统一在中间站取样,会不会对其他物料造成污染?都应有书面文件规定。
污染控制策略中提出:通常可根据识别的污染物及途径,对其分析来源,按照生产工艺流程列出每一个相关区域,然后对区域进行风险分析,分别形成文件。其中注意机械转移,生产过程中设备维修后移进洁净区需要消毒是日常生产中*常见的问题。
四、产品包装过程密封性检查
为防止整个药品包装系统在产品有效期内内容物损失、微生物侵入以及气体或其他物质的进入,保证药品持续符合安全与质量要求的能力,检查包装系统密封性。对试样的取样要求、检验步骤都做了详细明确的方法流程。另外在生产过程中开机调试时、更换铝箔硬片后、调整设备参数后、维修设备后都要做密封性检验。老师讲解的方法非常实用,可行性高,可以结合验证后升级检验方法。
根据目前生产状态,方方面面都有需要改进提高的部分,对照问题,正视问题,解决问题,不要讳疾忌医,一步步向规范靠拢,是企业逐步走向正规,做大做强所必经的途径。
河南中杰药业有限公司工会宣
唐雪艳供稿
2023年10月4日













