医药网12月21日讯近日,仿制药质量与疗效一致性评价办公室在CDE网站开通仿制药质量和疗效一致性评价专栏发布《289目录品种参比制剂基本情况表》,里面涵盖了289目录品种参比制剂情况,其中169个品种已有参比制剂,“不推荐参比制剂”的有26个品种,“无企业备案暂不推荐”的品种有14个,“研究中”品种有32个,其余都是没有推荐参比制剂的其它产品。
“不推荐参比制剂”两重天:
三类产品淘汰,两类产品免临床
“不推荐参比制剂”分为五类,分别是“存在安全性问题,国外已撤市”“国内特有品种,无有效批准文号且无企业备案”“国外OTC专论活性成分,药学研究应符合相应指导原则要求”“无有效批准文号且无企业备案”“药学研究应符合相应指导原则要求”。
“存在安全性问题,国外已撤市”的产品有2个,分别为酚酞片和司莫司汀胶囊。
“国内特有品种,无有效批准文号且无企业备案”产品也有2个品规,分别为氢溴酸山莨菪碱片10mg和鞣酸小檗碱片50mg。
“无有效批准文号且无企业备案”的产品有17个品规,分别为醋酸甲羟孕酮胶囊0.25g,多巴丝肼片0.125g(0.1g:0.025g)(左旋多巴:苄丝肼),氯雷他定片5mg,双氯芬酸钠缓释胶囊(Ⅰ)50mg及(Ⅲ)50mg、缓释片50mg、缓释片(Ⅰ)50mg、缓释片(Ⅴ)100mg,替加氟胶囊50mg及片200mg,硝苯地平缓释片(含Ⅱ)30mg,盐酸二甲双胍胶囊0.5g,盐酸氯雷他定胶囊及片5mg,盐酸左氧氟沙星胶囊0.5g,左氧氟沙星片0.2g。
以上三类产品品规预计将自然淘汰。此外,“无企业备案暂不推荐”的产品预计也会被自然淘汰。
另一方面,“国外OTC专论活性成分,药学研究应符合相应指导原则要求”的产品有3个,分别为葡萄糖酸钙片、碳酸氢钠片和维生素B2片。OTC专论活性成分是指适应症销售较长时间被证明安全有效的药品后就被列入OTC专论系统,对于列入OTC专论系统的药品,其上市无须经过FDA批准,但要求遵守GMP和药品登记。
“药学研究应符合相应指导原则要求”的产品有2个,分别为口服补液盐散(Ⅰ)和口服补液盐散(Ⅱ),这两个产品都是CDE此前发布的《289基药目录中可豁免或简化人体生物等效性试验(BE)品种名单(征求意见稿)》中的产品。
“三改产品”别再侥幸了!
必须按“三改”指南进行一致性评价
没有推荐参比制剂的其它产品中,部分产品的备注为“企业可按‘三改’技术指南进行研究和评估,选择参比制剂”。所谓“三改”技术指南,指的是2017年第27号公告《总局关于发布仿制药质量和疗效一致性评价工作中改规格药品(口服固体制剂)评价一般考虑等3个技术指南的通告》,里面包括《仿制药质量和疗效一致性评价工作中改规格药品(口服固体制剂)评价一般考虑》《仿制药质量和疗效一致性评价工作中改剂型药品(口服固体制剂)评价一般考虑》《仿制药质量和疗效一致性评价工作中改盐基药品评价一般考虑》3个技术指南。
笔者认为三个技术指南有两方面共性难点:一是立项的科学性、合理性和必要性。二是生物等效性试验或临床试验能否符合指南要求:“改盐基药品”要证明优效;“改剂型药品”以生物等效为立题依据且不显著改变药代动力学行为的要与原研剂型参比制剂进行生物等效性试验,“改剂型药品”已改变药代动力学行为的要与原研剂型参比制剂进行相对生物利用度研究及临床试验;“改规格药品”和参比制剂适应症和用法用量相同的,将已改规格药品和参比制剂以相同剂量给药(单次给药剂量不超过***大给药剂量)进行生物等效性试验。
从表1所示,仿制药质量与疗效一致性评价办公室基本已经将“三改”产品整理清晰,对应产品必须按“三改”指南进行一致性评价。
其中,没有在289目录中的“改剂型产品”,但同化学成分其它剂型在289目录且具参比制剂的产品需要警醒,如果289目录具参比制剂的产品获批,将会获得价格优待,届时再启动“三改”指南所提的项目将会非常被动。
备案信息包括地产化信息
地产化信息公布,不再需要进口参比制剂
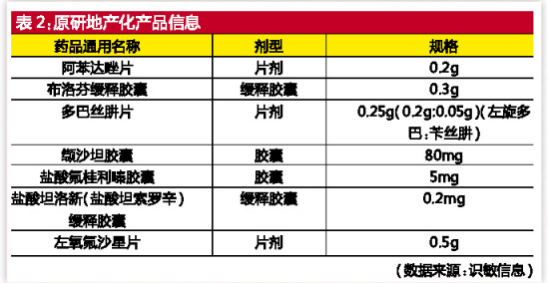
“研究中”产品主要包括“国内特有品种,需进一步研究”“麻醉药品,特殊管控”“原研地产审核中,暂未公布”三类。其中“原研地产审核中,暂未公布”公布了地产化的7个品规,其中缬沙坦胶囊此前公布的在欧盟上市的原研参比制剂已撤销。
通过一致性评价的原研药地产化信息公布后,国内企业将不需要进口国外的参比制剂。
小结<<<
《289目录品种参比制剂基本情况表》信息的公布,公开了哪些产品已面临自然淘汰,哪些“三改产品”需要按指南开展项目。289目录仅剩下一年的窗口期,积极竞争一致性评价的企业已逐步开始准备现场考察等待一致性评价获批。还在等待参比制剂干活的企业实质已是半放弃状态。
值得注意的是,一些销售规模比较大的289目录产品,有不少进口仿制药正在等待上市。如兰伯西实验室有限公司和印度瑞迪博士实验室有限公司都申报了硫酸氢氯吡格雷片,上海龙德医疗技术有限公司进口申报阿卡波糖片等。

质量部
2018年1月3日













