医药网4月8日讯4月3日,中国政府网发布《国务院办公厅关于改革完善仿制药供应保障及使用政策的意见》(下文称《意见》)。消息一发,今早在资本市场也引起了关注,不少在积极推进仿制药一致性评价的企业如华海药业、京新药业均有一定的涨幅。
在《意见》中可以看到明确的激励政策。例如,对于通过一致性评价的产品,要及时纳入采购目录,药品集中采购机构要按药品通用名编制采购目录,促进与原研药质量和疗效一致的仿制药和原研药平等竞争,还要促进仿制药替代使用。
同时,相关部门要发挥基本医疗保险的激励作用。加快制定医保药品支付标准,与原研药质量和疗效一致的仿制药、原研药按相同标准支付。通过医保支付激励约束机制,鼓励医疗机构使用仿制药。
笔者认为,加速仿制药替代原研,是降低药费支出的一条理想路径。对此,本文详细梳理了相关数据与一致性评价的相关进展。
美国
仿制药控费的国际经验
美国药品研发能力很强,但同时也是全球***大的仿制药市场,据IMS统计,2013年全球1600亿美元仿制药市场,美国就占了500亿美元。过去10年,仿制药为美国医疗卫生体系共计节省了1.67万亿美元。
图1 美国仿制药节省医疗卫生费用金额
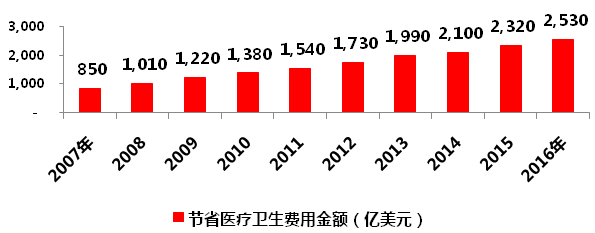
数据来源:IMS
研究显示,仿制药的价格将随着参与仿制药生产企业数量的增多而相应下降,当处于2~5家竞争时,价格迅速下滑到33%~52%,竞争厂家多了,则价格将降得更低。
图2 仿制药厂商数量与相对原研药价格关系
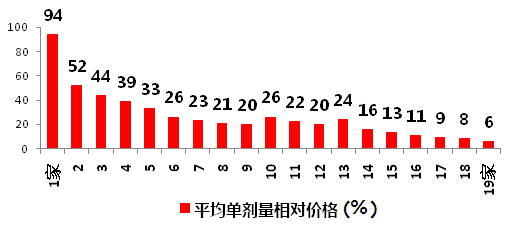
数据来源:《新英格兰医学杂志》
为何我国的仿制药没能替代原研药及过期专利药从而降低药费支出呢?笔者分析,主要有以下两个原因:
质量差异
长期以来,我国的仿制药质量与原研药有着巨大差距,也就不可能像国外仿制药那样替代原研药,从而降低药费支出。以扶他林(双氯芬酸钠)为例,国产仿制药的生物利用度与原研药存在较大差异。
图3以扶他林(双氯芬酸钠)为例,看我国仿制药与原研药差距
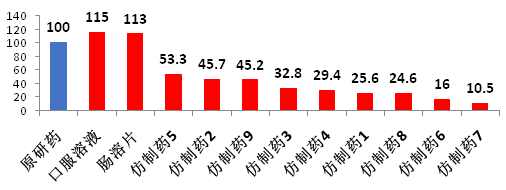
数据来源:上海医工院
招标层次
招标时,国产药与原研药及过期专利药不能在同一质量层次,原研及过期专利药价格也就难以降低。
表1 国产仿制药与原研药中标价格比较
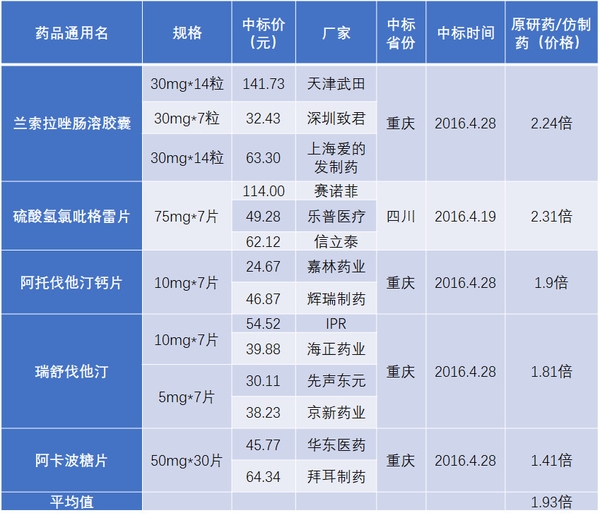
资料来源:药智网、海通证券研究所
中国
仿制药替代时代开启
笔者认为,发展仿制药的途径基本有两个,首先对存量批文进行一致性评价,同时加速仿制药的研发。
一致性评价进展汇总
已通过一致性评价的品种
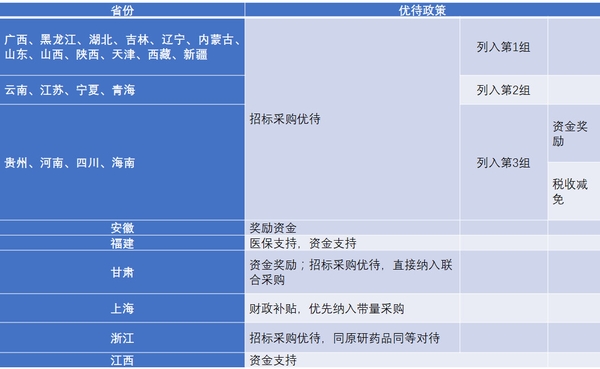
截至目前,已通过一致性评价的共15个品种(22个品规),其中289目录外的品种达10个(17个品规),可见企业看到了一致性评价的市场潜力,主动加速了一致性评价的进程。国务院和CFDA在多个重磅文件中都提出对通过一致性评价的品种给予医保支付、招标采购、资金支持三个斱面的优待,目前绝大多数省市也已出台落地一致性评价优惠政策。
表2 各省市落地一致性评价品种优惠政策汇总
注射剂一致性评价
2017年12月22日,CDE发布了《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,2018年3月13日CDE又发布了《药物注射剂研发技术指导意见》,将注射剂一致性评价提上了议事日程。和口服固体制剂相比,注射剂覆盖范围更广,涉及企业也更多。2016年我国注射剂用药规模达7577亿元,临床使用的西药中注射剂超过了70%。
事实上,已有多家企业提前在做注射剂一致性评价相关准备工作。截至2017年11月20日,拟进行一致性评价的注射剂品种有66个(表3),提出注射剂参比制剂备案的企业已有52家(表4)。
表3 已经提交备案资料的注射剂品种 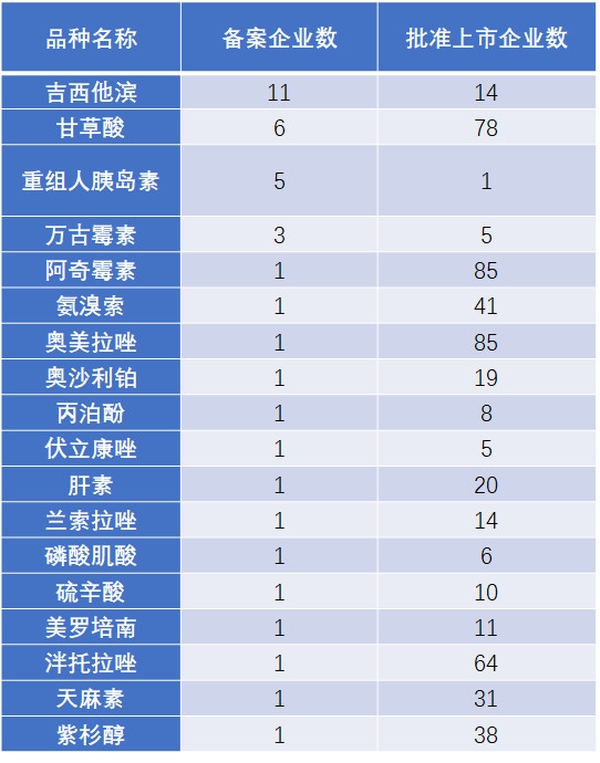
数据来源:搜狐
表4 已经提交备案资料的注射剂企业
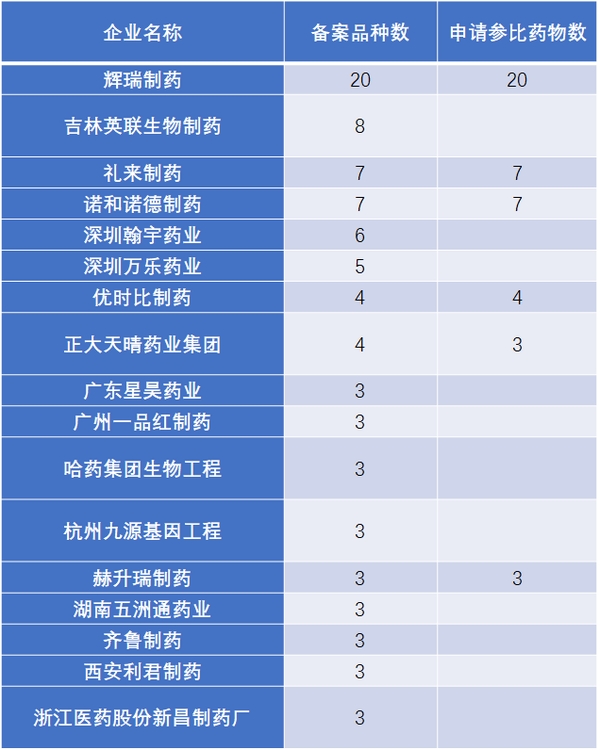
数据来源:搜狐
仿制药替代市场空间巨大
今后一段时间,将有多个药品专利到期,有巨大的市场空间供仿制药替代。
图4 到期专利药及仿制药替代市场潜力
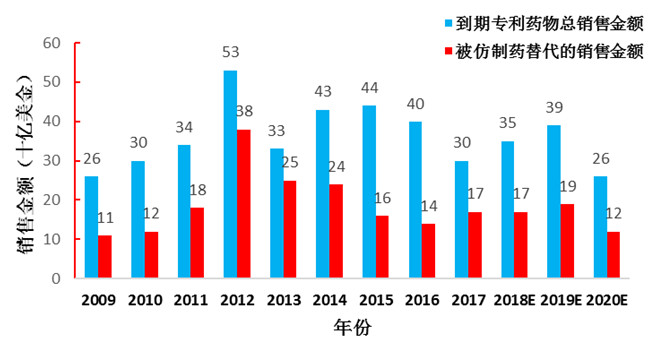
资料来源:FDA、Bloomberg、东兴证券研究所
对尚未上市的在研仿制药而言,完善专利制度是关键,2017年10月8日中办国办发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(42号文),提出了完善专利制度的具体措施,具体包括建立上市药品目录集、探索建立药品专利链接制度、开展药品专利期限补偿制度试点、完善和落实药品试验数据保护制度等。
通过列出专利和独占信息,保护专利权人合法权益,降低专利侵权风险,从而促进仿制药研发的积极性。
2017年12月29日,首版《中国上市药品目录集》发布,共收录了131个品种,203个品种规格,其中包括通过仿制药质量和疗效一致性评价的13个品种(17个品规)。CFDA将对新批准上市的新注册分类药品以及通过仿制药质量和疗效一致性评价的药品直接纳入《中国上市药品目录集》,实时更新。
在美国,***个向FDA递交ANDA、并含有PIV声明的仿制药,如果专利挑战成功,FDA将给予其180天的市场独占期。这期间,FDA不再批准其他的ANDA持有人上市,该仿制药可迅速抢占市场,并获取高额利润。
表5 首仿药180天独占期的市场价值
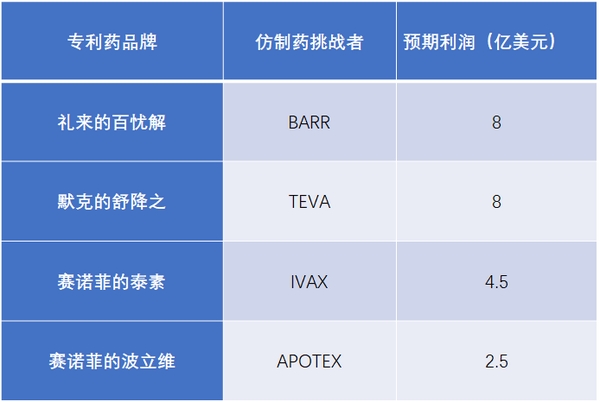
资料来源:公司公告、中信证券研究部
建立专利强制许可与药品优先审评审批制度也有益于仿制药研发。
图5 优先审评审批情况
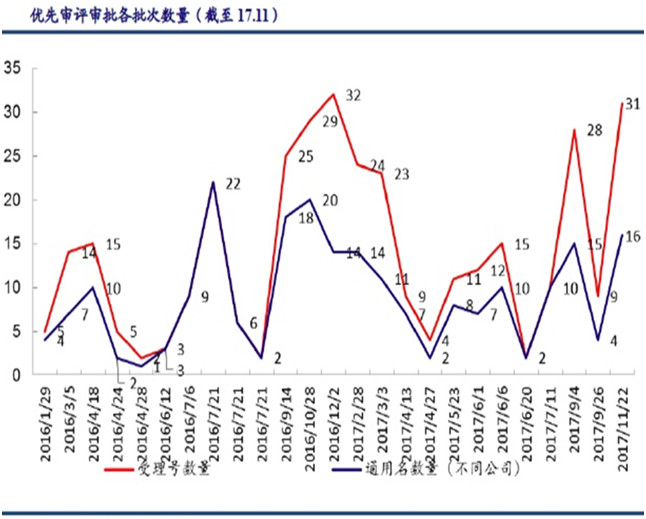
来源:CDE、中国银行证券研究部
2017年10月20日,CDE发布了关于征求《首批专利权到期、终止、无效尚且无仿制申请的药品清单》意见的通知,以引导仿制药研发生产。
表6 国内药企近几年重要专利挑战事件
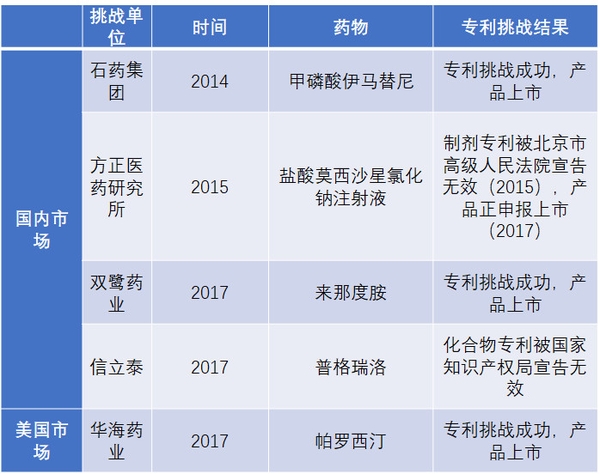
资料来源:公司公告、中信证券研究部
随着国内药企科研水平的不断提高,中国制药企业的仿制药也得到了FDA的认可,中国药企取得ANDA的数量由2008年的4个上升到了2017年的38个(图6),其中仅华海药业美国分公司普林斯顿2017年就在FDA获批了10个ANDA(图7)。在国内,CFDA还对“在中国境内用同一批生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请”给予优先审评审批资格等优待措施。
图6 近10年来FDA批准的中国药企ANDA(按申请号计)
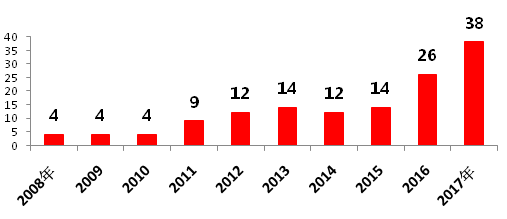
资料来源:药智网
图7 2017年中国药企获FDA批准ANDA数排名(按申请号计)
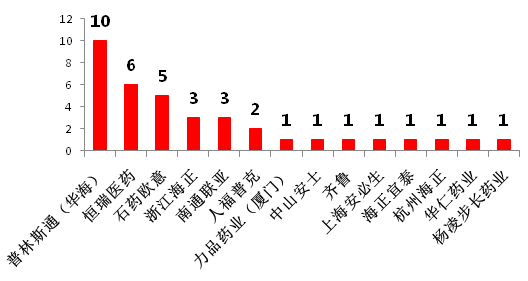
资料来源:药智网
加快一致性评价进程,对通过一致性评价的产品在招标采购和医保支付等方面给予和原研药同等待遇,不断完善专利制度,完善仿制药研发环境,加速仿制药发展,多举并进,提高原研替代率,切实减轻患者负担。













