中药是中国药品市场的一大中药特色领域,市场占比仅次于化学药,作为中国文化的一部分,传播影响着很多亚洲国家,特别是邻国日本和韩国也有着比较大中药产业。在西方医学传入国内以前中医中药在国内占统治地位,中医药就是医药的代名词。后来就像西方科技在其他领域中扮演规则制定者角色一样,医学的领域也是西方医学体系占主导地位,西方医药以其严谨、精确的科学精神征服了国人。作为传统文化组成部分的中医药仍然在我国的医药体系中占据不可替代的作用。
中药行业市场情况
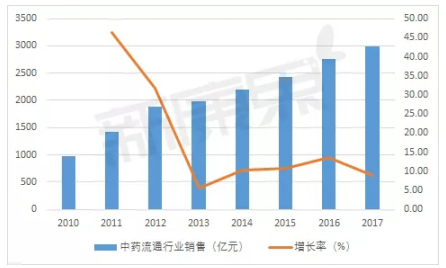
中康CMH数据显示,自2011年至2015年,心脑血管类疾病用药始终属于中成药临床终端用药的***大类,且主要集中于心脑血管疾病用药、肿瘤疾病用药、呼吸系统疾病用药。
中药经历了政策红利与压力
尽管西医药已经成为我国医药诊断治疗的主导,但是长期以来国内并没有完全融入西方的医疗体系,从顶层设计到基层用药都保留了中国特色,没有完全吸收国外医疗体系的精神,这可能是出于我国医疗基础跟欧美差距过大,难以国际接轨;也可能认为我国医疗由来就与国际不同,继续保持独特性也无可厚非。尽管也提出过中药国际化,带来了中药市场的短期繁荣,特别是中药注射剂市场快速增长,但事后看来,这是剂型的变化只是学习了西方医疗体系的型,恰恰背离了其精神,带来的问题远远多于成果。中药回归本质、回归传统再一次被提出,中药也经历了繁荣后的回归理性,甚至转为悲观。
从ICH说起
以前一个国家的新药要进入其他国家,必须重新在该国做临床研究,提交数据,等待审批,而这是一个漫长的过程,导致很多新药在其他国家上市要比发明过滞后4-8年,这不但导致人民健康福利滞后,也不符合经济效率。为解决这个问题,美国、欧盟与日本于1990年在布鲁塞尔启动了“人用药品注册技术规定国际协调会议”(简称ICH),试图通过协调,为药品研发和审批上市制定一个统一的国际性指导标准,加快新药在世界范围内的开发使用。这其中***核心的,就是药物研发数据的互认。
2017年以前,我国一直在ICH之外,这直接导致我国用药落后于发达国家,也间接导致我国医疗体系从上到下难以融入西方体系,产业链存在不市场化、扭曲难以捋顺等问题。
2017年6月19日,国家食品药品监督管理总局正式成为ICH成员,引起业界震动。不少业界人士认为,这是管理层对医疗顶层设计理念的转变,从短期来看,中国加入ICH和优先审评制度一样加速了新药进入临床,只不过前者是加速国外新药进入,后者是加速国内创新药进入。但是长期来说,ICH所代表的理念的转变可能要比优先审评大的多。
FDA对于药品的管理***基本的要求是”无毒、有效、质量可控”。这符合严谨的科学态度,也符合人文逻辑。即使是这样基本的要求,到目前也没有一家中国企业能够跨越,可见中西医药体系的鸿沟是很大的。以中国加入ICH体系为标志,从上到下的医疗理念加速融入西方发达国家所带来中药使用冲击是目前中药承压的***大来源。
处方中药的问题与挑战
中药按销售途径不同有处方药和OTC,前者来源于医生处方,多数在医院销售,而且买单的主力是国家医保,这与很多处方化学药很类似,受国家医药政策影响也很直接,也是近年来中药受冲击***大的部分。而在OTC零售端很多中药买单主力是个人消费者,买单方对产品有一定的认知和判断,能够自主选择,这样几乎就不受政策冲击,还是维持我国传统的中药生态形式。两个市场表现的海水与火焰也正源自于此,市场逻辑差别很大,需要分开来看。
处方中药近年来经历的阵痛不亚于***近的化学药市场,中国加速融入西方医疗体系,是中药处方药所面临的压力的增量因素。下面分别从FDA对药品的***基本三个方面(无毒、有效、质量可控)来看中药所面临的挑战,以及有可能的突围方向。
无毒。化学药上市有很严谨的临床前、临床研究和实验数据,对起效成分、作用机理、不良反应是比较明确的。中药天然在这些方面是不够清晰的,特别是不良反应的可知性与化学药差别很大。表现为很多中药不良反应是未知的,这就导致很多中药在使用时要***使用对象人群,***使用医院等级,特别是中药注射剂不良反应多发,这无疑压缩了中药市场。这是中药推广,特别是走出***受到的重要挑战。
有效。中药多种药材共同起作用,对于有效成分研究难以很精确,同样对于是否有效缺乏化学药循证医学的严谨数据支撑,导致很多中药不能有力的证明对疾病有治疗作用,使得很多中药作为疾病治疗的辅助用药存在。在医保收支压力增加的背景下,医保控费,进入精细化管理,腾龙换鸟的思想指导下,辅助用药成为了重点监控对象,***辅助用药已经对中药增速带来了实质性影响。
质量可控。在中药整个产业链中,从药材种植、产地加工、饮片生产、提取物生产、成药生产等秩序都比较混乱。没有好的药材,一定做不出好的中药饮片,也做不出好的中成药。没有好的中药,也就没有整个中医药的传承发展。产业链上游质量就显得特别重要,但是很多药材缺乏精确的检验标准,不可控因素多,生产企业出于节约成本等方面的考虑,被用于制造中药的中药材质量参差不齐,这直接导致下游成品药的质量难以保证,质量稳定性就无从谈起。隐患就埋下了,这样的不稳定性是发达国家医药市场难以接受的,同样制约着中药的国际推广。医院在使用中药时,也会带着担忧。
他山之石与启发
日本津村制药主要从事处方药和一般药品的制造和销售,是目前全球***大的汉方药制药公司,在复方配方颗粒制造方面颇有建树,其汉方药均以中医经典方剂为基础,***的质量控制体系使其一枝独秀。公司还通过子公司从事中草药提取物粉末和药物的生产和销售、经营配送药房和提供物流服务等业务。日本于1974年确认《一般用汉方制剂承认基准》,其中共包括210个汉方,这些处方均出自《伤寒论》及《金匮要略》等中医经典方剂。津村制药生产超过120种汉方药,以其***的质量控制体系和丰富的汉方药研发经验,津村制药在日本医疗用汉方制剂市场占有84%的份额。
津村制药实行严格的原材质量管理。津村为合格中药原材料供应商颁发“津村生药GACP认证”,GACP认证有效期为3年,每三年复核一次,一旦未通过认证,将永久取消供应商资格。津村生药GACP是以规范生产出符合公司要求的高品质生药原料的《生药生产标准书》、《生药可追溯体系》和《津村生药 GACP 指南》为主,参考了一般农作物的工序管理GAP认证制度并追加了“教育、监管、认证”制定而成,要求非常严格。
日本配方颗粒生产80%工序在中国本土完成,核心造粒过程全部在日本生产。各地生产的中药原料集中到深圳津村药业有限公司进行品质挑选,将劣质品(农药残留、微生物或重金属超标)的中药材淘汰掉。向津村学习,提升质量标准。日本非常重视汉方药制剂的质量控制,成分、含量、规格、生物药剂学评价标准等指标均被纳入质量评价。日本津村作为汉方药的龙头,一直注重对药品原材料的品质控制,包括制药标准化流程、药效均一性、药材追溯机制等。
因为缺乏明确的质量指标,原料药材来源、炮制工艺、过程可追溯就显得很重要。行业集中度提升,产生大的龙头公司,以公司信誉和高失信成本来给中药提供担保,发送质量保证的信号,可以大大降低市场对中药质量问题的担忧,提高中药接受程度,减少中药推广的难度。
大有可为的品牌中药
品牌中药有很强的消费属性,逻辑上很大程度上类似于以茅台为代表的高端白酒。文化影响、资源稀缺、品牌忠诚度等方面决定来了品牌中药跟高端白酒一样将长期存在,价值长期向上,可以不断挖掘品牌价值,比较成功的像云南白药、东阿阿胶。
以品牌中药为代表的大消费品再次受到关注,其背后是中药行业在政策的指引下回归传统,国家出台诸多政策,辅助用药出台、重点监控目录、新版医保目录等,其背后的指引逻辑是鼓励中药传统用法回归。而这些变化为传统中药产业链的不同环节带来新的发展机遇。
随着药品集中采购的推进,处方药面临药品招标降价压力,许多产品弃标转投OTC,成为下一个潜力增长点,品牌中药作为消费者接受度高,有议价能力的的品种会在院外这个越来越大的市场中取得得更多的收获。













